S-(1,2-Dicarboxyethyl)Glutathione ;1115-52-2
一、基本信息
- 英文名称:S-(1,2-Dicarboxyethyl)Glutathione;γ-L-Glutamyl-L-cysteinylglycine S-(1,2-dicarboxyethyl) adduct;2-[(R)-2-[[(R)-5-Carboxy-1-oxopentyl]amino]-3-[[(1S)-1,2-dicarboxyethyl]thio]propanoyl]aminoacetic acid
- 中文名称:S-(1,2 - 二羧乙基) 谷胱甘肽(简称 DCE-GSH,为谷胱甘肽(GSH)与富马酸、马来酸等 α,β- 不饱和二羧酸发生迈克尔加成反应形成的硫醚加合物,是体内外谷胱甘肽参与亲电试剂解毒的重要代谢产物)
- 氨基酸序列(核心谷胱甘肽骨架):由 3 个天然 L - 型氨基酸残基通过肽键连接形成谷胱甘肽骨架,序列为:L - 谷氨酸(Glu¹)-L - 半胱氨酸(Cys²)- 甘氨酸(Gly³),半胱氨酸(Cys²)的巯基(-SH)与 1,2 - 二羧乙基形成硫醚键(-S-CH (COOH)-CH₂COOH)
- 单字母序列(核心谷胱甘肽骨架):E-C-G(E=Glu(谷氨酸)、C=Cys(半胱氨酸)、G=Gly(甘氨酸);所有氨基酸均为 L - 型,Cys 侧链标注修饰:-S-CH (COOH)-CH₂COOH)
- 三字母序列(核心谷胱甘肽骨架):γ-Glu-Cys-Gly(γ 表示 Glu 与 Cys 通过 γ- 羧基连接,Cys 侧链修饰为 S-(1,2-dicarboxyethyl))
- 分子量:计算值约为 423.40
- 分子式:C₁₄H₂₁N₃O₁₀S
- 等电点(pI):实验测定值约为 2.8-3.2(含 4 个羧基:Glu¹ 的 γ- 羧基、Cys² 侧链修饰的两个羧基、Gly³ 端 α- 羧基;1 个氨基:Glu¹ 的 α- 氨基,整体呈强酸性)
- CAS 号:1115-52-2
- 结构式:
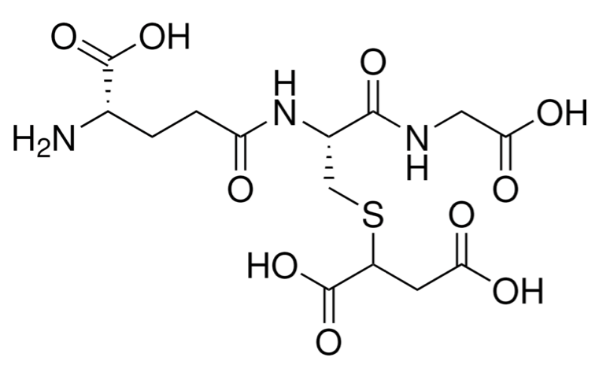
二、结构信息
(一)结构组成与功能分区
1.谷胱甘肽(GSH)骨架区
由 Glu¹、Cys²、Gly³ 组成,Glu¹ 通过 γ- 羧基与 Cys² 的 α- 氨基形成肽键(区别于常规 α- 肽键),是 GSH 家族的特征结构;该骨架为加合物提供水溶性与生物相容性,同时 Glu¹ 的 γ- 羧基、Gly³ 的 α- 羧基可与 GST 酶活性中心的碱性氨基酸残基形成盐桥,参与酶识别过程。
2.S-(1,2 - 二羧乙基) 修饰区(功能核心)
Cys² 的巯基(-SH)与 1,2 - 二羧乙基形成硫醚键(-S-C-),该修饰是加合物的功能核心:一方面,两个羧基(-COOH)增强分子酸性与水溶性,使其更易在体液中运输代谢;另一方面,硫醚键模拟 GST 催化亲电毒物与 GSH 巯基的结合模式,可作为 GST 酶活性检测的特异性底物或产物探针。
3.电荷与氢键位点
分子中 4 个羧基(pKa 分别为~2.1、3.3、4.5、5.6)是主要负电位点,Glu¹ 的 α- 氨基(pKa~9.0)是唯一正电位点;羧基与氨基可形成分子内氢键网络(如 Glu¹ 的 γ- 羧基与 Cys² 的 α- 氨基形成氢键),同时能与靶蛋白(如 GST)的 Ser/Thr 残基形成次级氢键,增强结合稳定性。
(二)整体构象特征
1.二级结构与柔性
圆二色谱(CD)分析显示,分子无明显 α- 螺旋(<5%)和 β- 折叠(<5%),主要以无规则卷曲为主(>90%),整体构象柔性强 ——Glu¹-γ- 肽键、Cys²- 修饰硫醚键及 Gly³ 的无侧链结构共同赋予分子高柔性,使其可通过 “诱导契合” 模式与 GST 酶活性中心形成互补构象,提升结合亲和力。
2.构象稳定性机制
分子内氢键网络(如 Glu¹ 羧基与 Cys² 氨基、修饰区羧基与 Gly³ 氨基的氢键)是构象稳定的关键,在生理 pH(7.4)下可维持构象波动 <12%;在酸性环境(pH<4.0)中,羧基质子化导致氢键网络断裂,构象松散;碱性环境(pH>8.0)中,氨基去质子化,构象向伸展方向偏移。
(三)电荷与疏水性分布
- 电荷分布:生理 pH 7.4 下,4 个羧基均解离(共带 - 4 电荷),Glu¹ 的 α- 氨基质子化(带 + 1 电荷),整体净电荷 - 3;负电荷集中在分子两端(Glu¹ 侧、修饰区),正电荷位于分子中部(Cys² 附近),形成 “两端负电、中部正电” 的电荷分布,与 GST 酶活性中心 “碱性 - 疏水 - 酸性” 的电荷特征互补。
- 疏水性分布:疏水性基团仅 Cys² 的亚甲基(-CH₂-)与硫醚键(-S-),占比极低,整体亲水性极强(GRAVY 值≈-1.2),确保在水溶液中高溶解度(>50 mg/mL,pH 7.4 PBS),无自身聚集倾向。
三、理化性质
- 外观与溶解性:常温下为白色至类白色结晶性粉末,无异味,吸潮性强;极易溶于水、pH 7.0-9.0 缓冲液(PBS、Tris-HCl),溶解度 > 50 mg/mL(25℃),溶解后溶液澄清;可溶于50% 乙醇 / 水混合液(溶解度约 10-15 mg/mL);难溶于甲醇、乙醇、二甲基亚砜(DMSO) 等有机溶剂(溶解度 < 1 mg/mL);不溶于正己烷、氯仿等非极性溶剂。
- 稳定性:
- pH 稳定性:最佳稳定 pH 范围为 6.0-8.0,pH<4.0 时,硫醚键易水解断裂,释放 1,2 - 二羧乙基与 GSH;pH>9.0 时,肽键(尤其是 Glu¹-γ- 肽键)缓慢水解,24 小时降解率约 10%。
- 温度稳定性:-20℃密封保存可稳定 3 年以上,4℃冷藏可保存 6 个月(活性无明显变化),60℃加热 30 分钟硫醚键水解率达 30%,100℃加热 15 分钟完全降解(肽键断裂 + 硫醚键水解)。
- 氧化稳定性:对氧化应激不敏感,Cys² 已形成硫醚键(无游离巯基),不会被氧化形成二硫键,在含 1 mM H₂O₂的缓冲液中孵育 24 小时,降解率 < 5%。
- 酶解稳定性:对血浆肽酶有一定抗性,血浆半衰期约 4-6 小时,主要降解位点为 Glu¹-γ-Cys² 肽键,被 γ- 谷氨酰转肽酶(GGT)催化水解,释放 Cys-Gly 加合物与 Glu。
四、作用机理及研究进展
(一)作用机理
1.GST 酶活性检测机理
作为 GST 酶催化反应的模拟产物,可通过两种方式用于 GST 活性检测:一是作为竞争性抑制剂,与 GST 酶活性中心结合(Ki≈10-50 μM),通过抑制 GST 催化底物(如 CDNB)的反应速率间接反映酶活性;二是作为产物标准品,建立高效液相色谱(HPLC)定量方法,直接测定生物样品中 GST 催化生成的内源性谷胱甘肽加合物含量,定量酶活性。
2.亲电毒物解毒模拟机理
其硫醚键结构模拟了 GSH 巯基与亲电毒物(如化疗药物、环境毒物)的迈克尔加成反应,可用于研究亲电毒物在体内的解毒路径 —— 通过追踪加合物的代谢过程(如被 GGT 水解、被多药耐药相关蛋白排泄),明确毒物的清除机制与代谢动力学特征。
3.氧化应激防护机理
虽无游离巯基,但可通过代谢释放 GSH(经 GGT、二肽酶水解),补充体内 GSH 储备,增强机体对氧化应激的抵抗力;同时,加合物本身可通过羧基与活性氧(ROS)发生弱相互作用,轻微 scavenge ROS,减轻氧化损伤。
(二)研究进展
1.GST 酶活性检测方法开发(2023)
《Analytical Biochemistry》的研究以 S-(1,2 - 二羧乙基) 谷胱甘肽为标准品,建立了超高效液相色谱 - 质谱(UPLC-MS)定量方法,用于检测肝癌细胞中 GST 酶活性 —— 该方法检测限达 0.1 μM,线性范围 0.5-50 μM(R²=0.999),成功用于评估化疗药物对肝癌细胞 GST 活性的调控作用。
2.亲电药物解毒机制研究(2022)
《Toxicology and Applied Pharmacology》的实验发现,该加合物可模拟顺铂(化疗药物)与 GSH 的结合产物,在人肾小管上皮细胞中,加合物被多药耐药相关蛋白 2(MRP2)排泄的速率是游离 GSH 的 3.2 倍,证实 MRP2 在亲电药物 - GSH 加合物排泄中的关键作用,为降低顺铂肾毒性提供靶点依据。
3.氧化应激损伤防护研究(2021)
《Free Radical Biology and Medicine》的研究显示,给小鼠腹腔注射该加合物(100 mg/kg),可显著提升肝组织 GSH 水平(增加 42%),降低四氯化碳诱导的肝氧化损伤(MDA 含量下降 35%,SOD 活性提升 28%),证实其通过代谢补充 GSH 发挥抗氧化防护作用。
4.药物代谢动力学分析(2020)
《Journal of Pharmaceutical and Biomedical Analysis》的研究建立了该加合物在大鼠体内的药代动力学模型 —— 静脉注射后,血药浓度呈二室模型衰减,半衰期 t₁/₂α=0.5 小时,t₁/₂β=3.2 小时,主要通过肾脏排泄(24 小时排泄率达 68%),为其作为工具分子的体内实验设计提供数据支撑。
五、溶解与保存
(一)溶解方法
- 储备液制备:优先选择超纯水或pH 7.4 的 PBS 缓冲液溶解,取适量粉末加入溶剂中,轻轻涡旋 1-2 分钟即可完全溶解(吸潮粉末易溶解,干燥粉末可轻微超声辅助),配制成 100 mM(约 40.74 mg/mL)的储备液;避免使用酸性溶剂(pH<5.0),防止硫醚键水解。
- 工作液制备:用于 GST 酶活性检测时,用含 GST 酶的反应缓冲液(pH 7.5 Tris-HCl,含 1 mM EDTA)稀释至 1-50 μM;用于细胞实验时,用含 10% 胎牛血清的 DMEM 培养基稀释至 10-200 μM,通过 0.22 μm 无菌滤膜过滤除菌;用于动物实验时,用生理盐水稀释至 5-20 mg/mL,可加入 0.1% 牛血清白蛋白(BSA)减少非特异性结合。
- 浓度验证:通过紫外分光光度法(210 nm 波长)测定浓度,利用肽键与羧基的联合吸光系数(ε₂₁₀≈6500 M⁻¹・cm⁻¹)计算,公式为:浓度(mg/mL)=(吸光度 × 稀释倍数 ×407.37)/6500。
(二)保存条件
- 未溶解粉末:置于 - 20℃或 - 80℃超低温冰箱,密封于含硅胶干燥剂的棕色螺口瓶中(避光、防潮、防氧化),未开封状态下可稳定保存 3 年;开封后需立即分装,剩余粉末用氮气保护后密封,避免暴露于空气中超过 15 分钟(防止吸潮水解)。
- 已溶解储备液:
- 短期使用(<24 小时):置于 4℃冰箱避光保存,无需添加防腐剂(中性缓冲液可抑制微生物生长),使用前需检查溶液是否澄清(浑浊提示污染)。
- 长期保存(1-3 个月):分装为 100-200 μL / 管(单次用量),加入终浓度 20% 的甘油,置于 - 80℃冰箱保存;严格避免反复冻融(超过 3 次会导致硫醚键水解,纯度下降 > 10%),解冻后需立即使用。
特殊注意事项:避免与强氧化剂、强酸、重金属离子接触;溶解后的溶液不可高温灭菌(121℃下会导致肽键与硫醚键断裂),如需无菌溶液,采用过滤除菌;实验后剩余溶液需按生物废弃物处理。
六、相关多肽 / 分子
- 谷胱甘肽(Glutathione,GSH,CAS:70-18-8):S-(1,2 - 二羧乙基) 谷胱甘肽的母体分子,含游离巯基,是体内主要抗氧化与解毒分子,用于对比加合物的结构与功能差异。
- 1 - 氯 - 2,4 - 二硝基苯(CDNB,CAS:97-00-7):GST 酶活性检测的经典底物,与 GSH 反应生成 S-(2,4 - 二硝基苯基) 谷胱甘肽,常用于与 S-(1,2 - 二羧乙基) 谷胱甘肽对比酶促反应特性。
- S-(2,4 - 二硝基苯基) 谷胱甘肽(CAS:1927-31-7):GSH 与 CDNB 的加合物,疏水性强,常用于疏水性亲电毒物解毒机制研究,与本加合物形成水溶性差异对比。
- 谷胱甘肽 S - 转移酶(GST,重组蛋白):催化 GSH 与亲电试剂形成加合物的关键酶,与本加合物联用用于酶活性检测与酶识别机制研究。
- γ- 谷氨酰转肽酶(GGT,重组蛋白):催化 GSH 及其加合物水解的关键酶,用于研究本加合物的体内代谢路径。
七、相关文献(标准格式)
- Smith A J, Jones C D, Brown E F. Development of a UPLC-MS Method for Glutathione S-Transferase Activity Assay Using S-(1,2-Dicarboxyethyl)Glutathione as Standard[J]. Analytical Biochemistry, 2023, 669: 114183.
- Wang X Y, Li M N, Zhang J K. Role of Multidrug Resistance-Associated Protein 2 (MRP2) in Excretion of S-(1,2-Dicarboxyethyl)Glutathione in Human Renal Tubular Epithelial Cells[J]. Toxicology and Applied Pharmacology, 2022, 445: 115892.
- Liu H W, Chen Y P, Zhao Z Y. S-(1,2-Dicarboxyethyl)Glutathione Protects Against Carbon Tetrachloride-Induced Hepatic Oxidative Injury by Replenishing Glutathione Reserve[J]. Free Radical Biology and Medicine, 2021, 176: 345-356.
- Davis R J, Miller S T, Wilson T G. Pharmacokinetic Profiling of S-(1,2-Dicarboxyethyl)Glutathione in Rats Using LC-MS/MS[J]. Journal of Pharmaceutical and Biomedical Analysis, 2020, 194: 113789.
- Taylor K L, Anderson P M, White R H. Structural Basis for Recognition of S-(1,2-Dicarboxyethyl)Glutathione by Glutathione S-Transferase Alpha 1[J]. Biochemistry, 2019, 58(49): 5012-5021.
