2026新人教版九年级化学全一册(五四)-电子课本(最高清下载打印)
创始人
2026-02-05 12:01:54
0次
2026年学生将迎来新版教材,新教材将更加重视思维和阅读!为了方便广大学生在暑假预习新学期的课本知识,我们整理了2026新教版九年级化学全一册(五四)一电子课本,以图片的形式呈现给大家,希望对同学们的暑期学习有所帮助。
如需全套电子课本PDF版,请关注公众号“桃李科普”回复:“电子课本”
教版九年级化学全一册(五四)-电子课本在线阅读



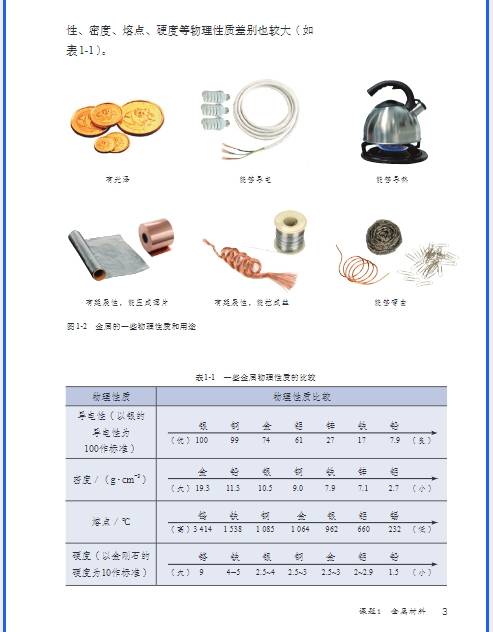

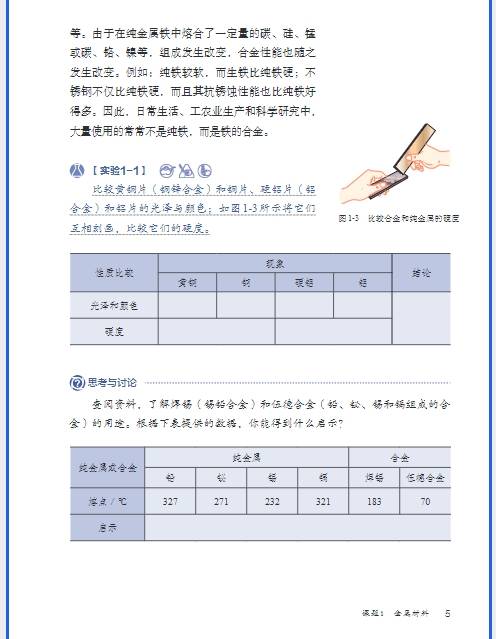



九年级化学核心知识全梳理(分模块 + 考点 + 题型 + 技巧)
九年级化学是入门 + 基础 + 中考核心,重点围绕物质构成、化学用语、化学反应、化学计算、实验探究五大模块,其中化学方程式、酸碱盐、实验探究是中考重难点,以下按模块梳理核心考点、高频题型及解题技巧,精准突破提分。
一、物质构成的奥秘(基础核心,化学用语必过关)
(一)物质的组成与分类
- 核心知识点
- 物质构成:分子(保持物质化学性质的最小粒子,如 H₂O、O₂)、原子(化学变化中的最小粒子,如 Fe、C)、离子(带电的原子 / 原子团,如 Na⁺、Cl⁻、SO₄²⁻)。
- 元素:具有相同质子数(核电荷数)的一类原子总称;地壳中含量前四位:O、Si、Al、Fe;元素周期表(原子序数 = 质子数 = 核电荷数 = 核外电子数)。
- 物质分类:混合物(空气、溶液、合金)、纯净物(单质、化合物);化合物分氧化物(两种元素,一种是 O,如 CO₂、H₂O)、酸(H⁺+ 酸根,如 HCl、H₂SO₄)、碱(金属离子 + OH⁻,如 NaOH、Ca (OH)₂)、盐(金属离子 + 酸根,如 NaCl、Na₂CO₃)。
- 重点题型
- 物质构成粒子判断;元素概念应用;物质分类(混合物 / 纯净物、单质 / 化合物 / 氧化物)。
- 元素周期表信息提取(原子序数、质子数、相对原子质量、元素类别)。
- 解题技巧
- 分类抓 “定义关键词”:氧化物必须 “两种元素 + 含氧”,酸必含 H⁺,碱必含 OH⁻,盐是 “金属 / 铵根 + 酸根”。
- 元素周期表:左上角 = 原子序数,右上角 = 元素符号,中间 = 元素名称,下方 = 相对原子质量。
(二)化学用语(中考必考,失分重灾区)
- 核心知识点
- 元素符号:书写(一大二小,如 Fe、Cu);意义(宏观表元素,微观表 1 个原子,金属 / 稀有气体 / 固态非金属还表物质)。
- 化学式:意义(宏观表物质及组成,微观表 1 个分子及构成);书写(单质:金属 / 稀有气体 / 固态非金属直接写元素符号,气态非金属加下标,如 O₂、N₂;化合物:正价在前,负价在后,化合价代数和为 0)。
- 化合价:常见元素化合价(K/Na/Ag+1,Ca/Mg/Ba/Zn+2,Al+3,O-2,Cl-1);原子团化合价(SO₄²⁻-2,CO₃²⁻-2,NO₃⁻-1,OH⁻-1,NH₄⁺+1);化合价规则(化合物中正负化合价代数和为 0,单质中为 0)。
- 化学方程式:书写原则(客观事实、质量守恒);步骤(写→配→注→标);意义(表反应物、生成物、反应条件;表粒子个数比;表质量比)。
- 重点题型
- 元素符号、化学式、离子符号书写与意义;化合价计算(已知化学式求某元素化合价,或已知化合价写化学式)。
- 化学方程式书写(配平、条件、气体 / 沉淀符号);化学方程式意义理解。
- 解题技巧
- 化合价计算:设未知元素化合价为 x,根据 “代数和为 0” 列方程求解(如 KMnO₄中 Mn 化合价:+1+x+(-2)×4=0→x=+7)。
- 化学方程式配平:常用最小公倍数法、观察法、奇数配偶法;配平后检查原子种类、个数是否守恒。
- 符号区分:离子符号(右上角标电荷,如 Mg²⁺)、化合价(正上方标,如Mg+2)、化学式(下标表原子个数,如 H₂O)。
(三)原子结构与元素性质
- 核心知识点
- 原子结构:原子核(质子 + 中子,质子带正电,中子不带电)、核外电子(带负电);原子中:质子数 = 核电荷数 = 核外电子数。
- 核外电子排布:分层排布,第一层最多 2 个,第二层最多 8 个,最外层最多 8 个(He 为 2);最外层电子数决定元素化学性质(金属 < 4 易失电子,非金属≥4 易得电子,稀有气体 = 8 稳定)。
- 离子形成:金属原子失电子→阳离子(带正电),非金属原子得电子→阴离子(带负电);离子中:质子数≠核外电子数(阳离子质子数 > 电子数,阴离子相反)。
- 重点题型
- 原子结构示意图判断(原子 / 离子、元素类别、得失电子);元素化学性质与最外层电子数关系。
- 离子符号书写与结构示意图对应。
- 解题技巧
- 结构示意图:圆圈内 = 质子数,弧线 = 电子层,弧线上数字 = 该层电子数;质子数 = 电子数为原子,不等为离子。
- 元素类别:金属(最外层 < 4)、非金属(最
相关内容
最新资讯
2026秋北京版四年级数学上册...
2026 秋北京版四年级数学上册新教材围绕大数的认识、三位数乘两位数、除数是两位数的除法、线与角、方...
2026年泉州硕士留学中介TO...
作为一名从业逾八年的华南地区国际教育规划师,我常年关注福建省,特别是泉州地区的留学服务市场动态。撰写...
寒门学子唐尚珺:瞒着父母高考7...
在二〇二二年,广西的高考考场上,青春的气息弥漫在每一个角落。年轻的考生们脸上写满了激动和紧张,而在人...
2026春新人教版三年级下册数...
这份人教版三年级下册数学第一单元测试卷,紧扣教材核心,覆盖平移、旋转、轴对称图形三大图形运动知识点,...
韩国三星“长公主”之子被首尔大...
韩国三星集团“长公主”李富真的儿子任东贤(音译,Lim Dong-hyun)日前在首尔一家私立补习学...
取消中高考的预言背后,是一代人...
大家好,我是裤衩,今天跟大家讲的是上海两会传出的一个挺炸裂的观点:有委员说,取消中高考是早晚的事。 ...
2027东华大学MJC新传专硕...
*A-历年考研真题试卷与参考答案* 东华大学学硕停招 2019-2025年东华大学334新闻与传播综...
喜报!江苏卫视、ai荔枝获“印...
2月3日,“印象中国”2025短视频征集展示活动评选揭晓暨2026活动启动仪式在南京举行。本次活动中...
002716,跌停!国际金价大...
A股贵金属板块早盘下挫,湖南黄金、湖南白银(002716)跌停,晓程科技、四川黄金、山东黄金等股跟跌...
“寒假弯道超车,我做对了什么?...
一到寒假你是不是就开始纠结,怎么才能给孩子规划出一个有意义的假期? 安排课程吧,担心学得多了孩子出现...
