2025新教材苏教版高中化学(必修)电子课本(最高清下载打印)
2025年学生将迎来新版教材,新教材将更加重视思维和阅读!为了方便广大学生在暑假预习新学期的课本知识,我们整理了2025新
苏教版高中化学(必修)一电子课本,以图片的形式呈现给大家,希望对同学们的暑期学习有所帮助。
如需全套电子课本PDF版,请关注公众号“桃李科普”回复:“电子课本”
苏教版高中化学(必修)电子课本在线阅读






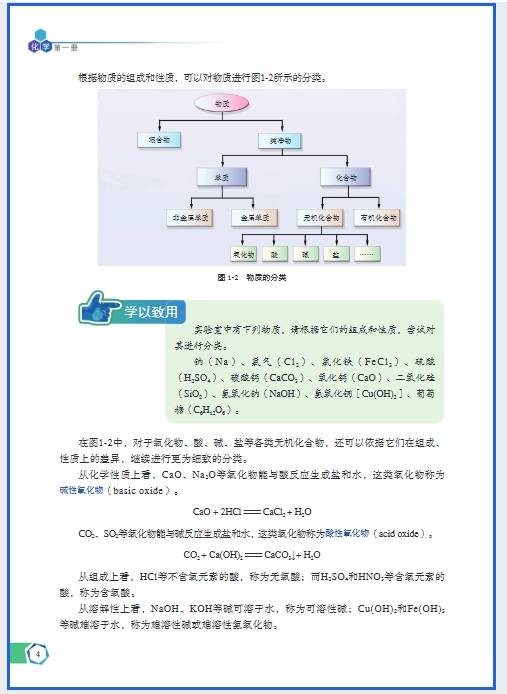

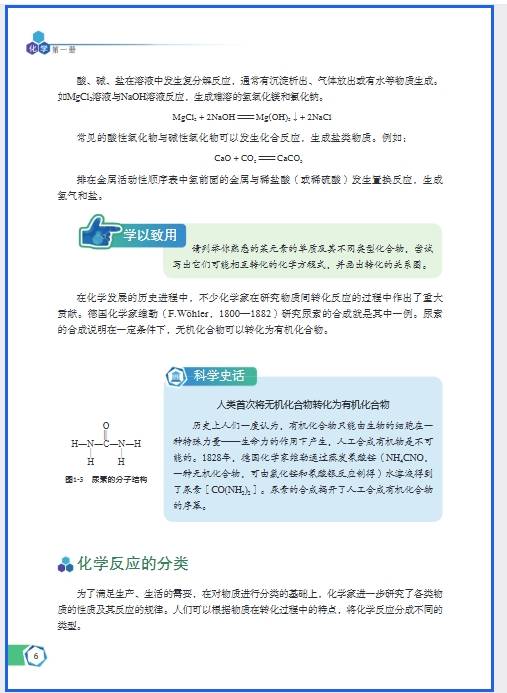





高中化学 “基础概念” 模块是整个化学学习的 “工具层”(如物质的量、化学用语、物质分类),特点是 “概念抽象、公式关联强、应用场景固定”。分层记忆的核心是先 “理解本质”,再 “拆解逻辑”,最后 “场景应用”,避免孤立记定义或公式。以下按 “3 个分层步骤” 展开,结合具体实例提供可落地的记忆策略:
分层 1:先 “拆解概念本质”—— 拒绝 “背定义”,搞懂 “为什么要这个概念”
基础概念的产生往往是为了解决 “特定问题”(如 “物质的量” 是为了连接微观粒子和宏观质量,“电解质” 是为了区分 “能否导电的化合物”)。第一步要先明确 “概念的核心目的”,再拆解 “定义中的关键限定词”,避免因漏看限定词导致理解偏差。
1. 示例 1:物质的量(n)—— 化学计量的 “桥梁” 概念
- 核心目的:解决 “微观粒子(原子、分子)看不见、数不清,无法直接称量” 的问题,建立 “微观粒子数(N)” 与 “宏观质量(m)、体积(V)” 的桥梁。
- 定义拆解:“表示含有一定数目粒子的集合体”,关键限定词:
- “粒子”:特指微观粒子(分子、原子、离子、质子、电子等,不能是宏观物体,如 “1mol 苹果” 错误);
- “集合体”:把 “6.02×10²³ 个粒子” 打包成 1 个 “单位”(类似 “1 打鸡蛋 = 12 个”,1mol 粒子 = 6.02×10²³ 个,这个数值叫阿伏伽德罗常数 Nₐ)。
- 记忆技巧:用 “生活类比” 理解 —— 把 “微观粒子” 比作 “米粒”,“物质的量” 比作 “斤”,我们无法直接数米粒数量,但可以用 “斤”(物质的量)称量,再通过 “1 斤米≈多少粒”(Nₐ)换算成米粒数(N)。
2. 示例 2:电解质与非电解质 —— 化合物的 “导电属性” 分类
- 核心目的:区分 “化合物能否在水溶液或熔融状态下导电”,为后续 “离子反应” 铺垫(只有电解质才能电离出离子,参与离子反应)。
- 定义拆解:
- 概念关键限定词反例(为什么不满足)电解质① 化合物(排除单质、混合物);② 水溶液 / 熔融状态下能导电(两者满足其一即可)铜(单质,不是化合物);盐酸(混合物,不是化合物)非电解质① 化合物;② 水溶液和熔融状态下都不能导电蔗糖(化合物,水溶液和熔融都不导电);酒精(同上)
- 避坑关键:记 “两个必须”—— 必须是 “化合物”,必须看 “导电条件”(如 NaCl 固体不导电,但熔融或溶于水导电,是电解质;CO₂溶于水导电是因为生成 H₂CO₃,不是 CO₂本身导电,故 CO₂是非电解质)。
- 记忆技巧:列 “判断流程图”,遇到物质先判断 “是否为化合物”→ 再判断 “是否在水溶液 / 熔融状态导电”→ 确定是电解质 / 非电解质。
分层 2:再 “串联逻辑关系”—— 把 “孤立概念 / 公式” 连成 “网络”
基础概念中很多内容存在 “因果关系”(如 “物质的量” 衍生出 “摩尔质量、气体摩尔体积、物质的量浓度”)或 “对比关系”(如 “化学方程式与离子方程式”“氧化还原反应与非氧化还原反应”)。第二步要通过 “公式推导” 或 “对比表格”,把孤立的知识点连成 “逻辑链”,避免记混。
1. 示例 1:物质的量相关公式 ——“以 n 为核心” 的推导链
“物质的量(n)” 是核心,其他物理量(N、m、V、c)都通过 n 关联,推导逻辑基于 “n 的定义”:
- 第一步:从定义出发:n = N/Nₐ(N 是粒子数,Nₐ是阿伏伽德罗常数,固定值≈6.02×10²³mol⁻¹)→ 解决 “微观粒子数与 n 的换算”;
- 第二步:关联宏观质量:1mol 粒子的质量叫 “摩尔质量(M)”,数值上等于 “相对原子 / 分子质量”(如 H₂O 的 M=18g/mol)→ 推导 n = m/M(m 是质量)→ 解决 “质量与 n 的换算”;
- 第三步:关联气体体积:标准状况(0℃、101kPa)下,1mol 任何气体的体积约为 22.4L,叫 “气体摩尔体积(Vₘ)”→ 推导 n = V/Vₘ(V 是气体体积)→ 解决 “气体体积与 n 的换算”;
- 第四步:关联溶液浓度:单位体积溶液中溶质的 n 叫 “物质的量浓度(c)”→ 推导 n = cV(V 是溶液体积,单位为 L)→ 解决 “溶液浓度与 n 的换算”。
- 记忆技巧:画 “公式关系图”,以 n 为中心,四周连接 N、m、V、c,标注每个公式的 “适用条件”(如 Vₘ只适用于 “标准状况 + 气体”,cV 中的 V 是 “溶液体积” 不是溶剂体积):
- plaintext
- N(粒子数)←—Nₐ—→ n(物质的量) —→M—→ m(质量)
- ↑ ↓
- ↓ ↑
- Vₘ(气体)←—V(体积) c(浓度)—→V(溶液)
2. 示例 2:化学用语 ——“从宏观到微观” 的表达对比
化学用语是 “描述化学变化的语言”,不同用语(化学方程式、离子方程式、热化学方程式)的适用场景不同,通过 “对比表格” 明确差异,避免写错:
用语类型核心作用关键要素(必须包含)示例(盐酸与 NaOH 反应)化学方程式描述 “反应物、产物及比例”① 反应物、产物化学式;② 配平;③ 反应条件;④ ↑/↓HCl + NaOH = NaCl + H₂O(无气体 / 沉淀,不用标↑/↓)离子方程式描述 “离子间的反应”① 拆成离子(强酸、强碱、可溶性盐);② 配平(电荷守恒);③ 删去不参与反应的离子H⁺ + OH⁻ = H₂O(Cl⁻、Na⁺不参与反应,删除)热化学方程式描述 “反应的能量变化”① 配平;② 各物质状态(s/l/g/aq);③ ΔH(正负、单位 kJ/mol)HCl(aq) + NaOH(aq) = NaCl(aq) + H₂O(l) ΔH=-57.3kJ/mol
- 记忆技巧:记 “优先级”—— 写离子方程式先 “拆”(判断能否拆),写热化学方程式先 “标状态”(状态影响 ΔH 数值),写化学方程式先 “配平”(原子守恒)。
分层 3:最后 “场景化应用”—— 通过 “例题 +
